Auteurs
Carlos Diaz Lopez et Aymeric Le Neindre, de l’organisme FKNL Centre de formation pour kinésithérapeutes, dont vous pouvez parcourir les formations, pour la revue Kinésithérapie Scientifique numéro 643 (juin 2022).
Mots-clés
Échographie, Réanimation
Résumé
En soins intensifs et réanimation, le kinésithérapeute est impliqué dans la prise en charge de diverses pathologies et dysfonctions. L’hypoxémie, la dyspnée, les altérations fonctionnelles ou les troubles de la déglutition sont quelques exemples des signes d’appel d’une évaluation par le kinésithérapeute [1].
Ainsi, celui-ci pourra être impliqué dans le sevrage de la ventilation mécanique, le traitement des déficiences pulmonaires ou encore la récupération des capacités fonctionnelles ou de déglutition.
L’évaluation du patient (de l’état d’aération pulmonaire, musculaire, de la déglutition…) permet au kinésithérapeute d’établir un diagnostic, évaluer les possibilités de la prise en charge à modifier le pronostic et choisir les moyens les plus efficaces pour y parvenir. De plus, il doit permettre de définir des critères de qualité pour le traitement, permettant d’adapter la thérapeutique en fonction de la réponse.
Les outils d’évaluation habituels, comme l’auscultation, l’imagerie, l’évaluation de la force musculaire ou l’examen clinique de la déglutition, manquent de précision ou de fiabilité. Certaines de ces évaluations nécessitent la coopération du patient, difficile à obtenir dans certains contextes et notamment dans les premières phases de la réanimation. L’échographie est un outil diagnostic non invasif, non irradiant et simple d’utilisation qui apparaît comme une excellente alternative dans ces situations, améliorant le processus diagnostic des kinésithérapeutes dans de nombreux cas qui seront détaillés ci-après [2, 3].
Sommaire
1- Échographie dans l’évaluation respiratoire du patient
2- Échographie dans le monitorage du patient
3- Échographie dans le sevrage de la ventilation mécanique
4- Échographie dans l’évaluation musculaire du patient
5- Discussion
6- Conclusion
Échographie dans l’évaluation respiratoire du patient
Durant le processus diagnostic en réanimation, kinésithérapeute réalise un examen clinique et analyse les examens paracliniques à sa disposition. Le plus souvent, il a recours à l’inspection, l’auscultation, la radiographie du thorax ou encore la gazométrie. La supériorité des capacités diagnostiques de l’échographie comparée à l’auscultation et à la radiographie thoracique face aux mêmes pathologies, font de l’échographie un outil prometteur pour le kinésithérapeute [4, 5].
Dans d’autres numéros de cette même revue, les auteurs ont présenté plusieurs cas cliniques où l’échographie a permis d’améliorer l’évaluation du patient en adaptant la stratégie thérapeutique en fonction des données apportées par l’échographie [6, 7].
Les meilleures performances diagnostiques de l’échographie pourraient impacter la décision médicale lors de l’évaluation des patients hospitalisés en réanimation. Cet impact a été évalué par Xirouchaki et al. [8], démontrant que l’utilisation de l’échographie modifiait la stratégie thérapeutique mise en place dans 47 % des cas.
L’impact de l’utilisation de l’échographie sur le choix diagnostic et le traitement en kinésithérapie respiratoire chez le patient hypoxique en réanimation a fait l’objet d’une étude récem-ment publiée par les auteurs révélant un changement de diagnostic dans 40 % de cas après consultations des données échographiques. Parmi les situations où le kinésithérapeute a décidé un changement de traitement, ce changement était majeur dans 41 % des cas [9].
Pour réaliser cette évaluation, chaque hémithorax est divisé dans un total de 6 régions. 2 lignes verticales délimitées par la région axillaire (axillaire antérieure et postérieure) définissant une région antérieure, latérale et postérieure et une ligne horizontale subdivisant chacune de ces régions en supérieure et inférieure.
L’évaluation de l’état d’aération pulmonaire se fera en évaluant le niveau d’aération dans chacune de ces régions. 4 niveaux d’aération pourront être observés.
Pour chaque niveau d’aération, des points seront alloués comme suit :
- aération normale : présence de glissement pleural, des lignes A et moins de deux lignes B isolées (score = 0) ;
- perte modérée d’aération : présence de lignes B multiples et bien définies (au moins 3 dans un même espace intercostal) (score = 1) ;
- perte sévère d’aération : présence de lignes B coalescentes (score = 2) ;
- consolidation pulmonaire (score = 3).
La somme du score de chaque région définit le score d’aération pouvant aller de 0 à 36.
Le kinésithérapeute pourra aussi compléter l’évaluation par l’analyse qualitative des consolidations pulmonaire et/ou épanchements pleuraux.
Enfin, l’échographie peut être utilisée pour l’évaluation du diaphragme pour laquelle elle possède une meilleure précision et fiabilité que les outils d’évaluation habituellement utilisés.
Échographie dans le monitorage du patient
Au-delà de son apport diagnostic, l’échographie revêt un intérêt grandissant dans la littérature dans le suivi de l’évolution du malade. En effet, son excellente précision diagnostique permet de suivre l’amélioration ou la dégradation de l’état du patient. Le kinésithérapeute peut ainsi adapter le traitement face aux changements du contexte clinique.
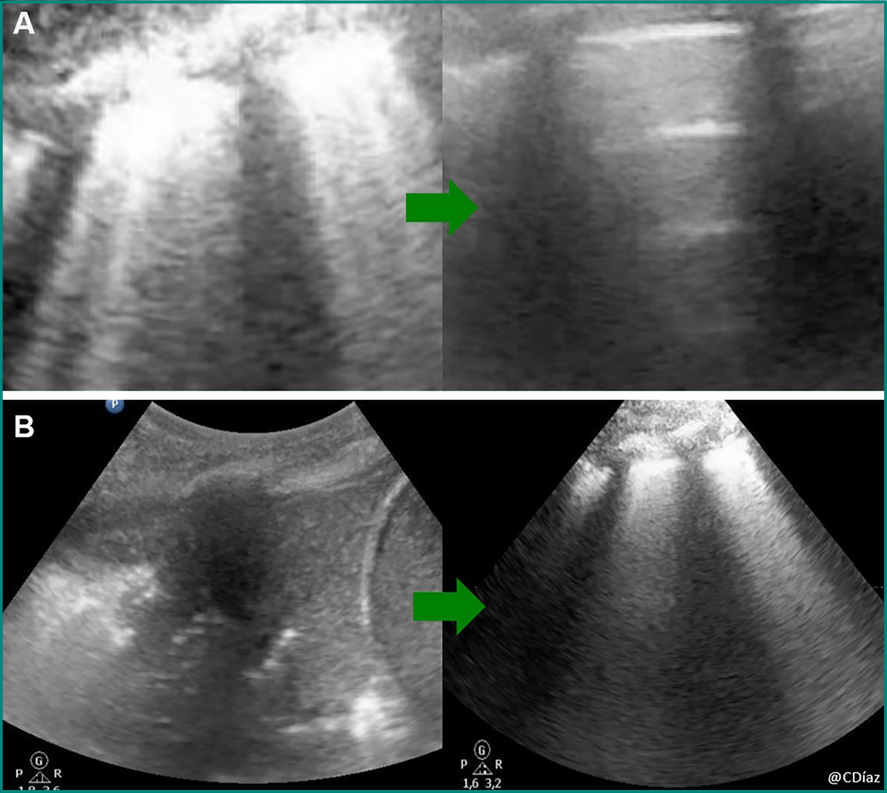
De plus, sa facilité d’utilisation permet de l’utiliser durant la séance permettant de monitorer la réponse du malade au traitement proposé. Ainsi, lors des techniques de recrutement alvéolaire par exemple, l’échographie peut être utilisée pour guider le réglage de la pression expiratoire positive qui se fera progressivement jusqu’à l’obtention des signes de récupération de l’aération pulmonaire [10, 11]. La figure 1 montre un exemple de 2 cas où l’état d’aération s’améliore durant et après le traitement par manœuvres de recrutement alvéolaire.
Échographie dans le sevrage de la ventilation mécanique
Le processus du sevrage de la ventilation mécanique est une étape clé du séjour en réanimation. Le pronostic du malade peut être fortement impacté en cas d’échec d’extubation dont le taux peut dépasser le 20 % chez cer- taines populations spécifiques [12, 13].
Les causes d’échec pouvant être multiples (œdème aigu du poumon, dysfonction diaphragmatique…), l’identification des dysfonctions à l’origine de celles-ci devient indispensable afin de mettre en place le traitement permettant d’écourter la durée de ventilation et réduire le risque d’un nouvel échec.
L’échographie, permettant l’évaluation cardiaque, de la plèvre, de l’aération pulmonaire ou encore du diaphragme offre une véritable alternative pour le kinésithérapeute. En effet, elle peut être réalisée durant l’épreuve de sevrage, permettant le diagnostic de 2 causes souvent à l’origine d’échec : les dysfonctions diaphragmatiques et les œdèmes cardiogéniques induits par le sevrage de la ventilation.
Dysfonction diaphragmatique
Les patients sous ventilation mécanique présentent souvent des dysfonctions diaphragmatiques. Elles sont, quant à elles, associées à un moins bon pronostic, à un sevrage difficile et à un taux d’échec d’extubation accru [12, 14].
L’évaluation des capacités prédictives de l’échographie diaphragmatique a fait l’objet d’une méta-analyse récemment publiée par l’un des auteurs de ce numéro. Les données analysées révèlent une spécificité de 84 % (95 % CI 0,73–0,91) et une sensibilité de 70 % (95 % CI 0,57–0,80).
Les données apportées dans cette méta-analyse indiquent qu’il existe un risque élevé d’échec d’extubation en cas de fraction d’épaississement du diaphragme inférieure à 30 % ou d’une excursion du diaphragme inférieure à 1 cm. En revanche, l’absence de dysfonctionnement du diaphragme n’implique pas l’absence de risque d’échec d’extubation car il peut se produire pour d’autres raisons non liées à l’activité diaphragmatique [15].
Œdème pulmonaire de sevrage
Durant l’épreuve de ventilation spontanée, le passage en pression négative au détriment de la ventilation en pression positive produit, entre autres, une augmentation du travail respiratoire, la négativation de la pression intrathoracique et l’augmentation de la pression intra-abdominale [16]. Ces phénomènes seront d’autant plus importants en présence d’antécédents de maladie cardiaque, d’une pression positive de fin d’expiration intrinsèque si le patient souffre de bronchopneumopathie chronique obstructive, ou d’une obésité.
Les œdèmes du poumon induits par le sevrage, quant à eux, ont une incidence variant de 44 à 87 % [17]. Son diagnostic peut être évoqué devant la survenue d’une détresse respiratoire brutale lors de l’épreuve de ventilation spontanée. L’échographie permet ce diagnostic face à une augmentation de 6 lignes B dans les 4 régions antérieures.
La reconnaissance de plus de 6 lignes B compte avec une sensibilité de 88 % (95 % CI 64-98), spécificité de 88 % (95 % CI 62-98) et une valeur prédictive positive de 82 % (95 % CI 67-97) [17].
Échographie dans l’évaluation musculaire du patient
L’exposition du patient aux traitements médicaux, à l’inactivité et l’alitement augmentent le risque de développer une « faiblesse acquise en unité de soins intensifs ». Cette faiblesse est associée à une durée de ventilation mécanique et de séjour prolongés et à une mortalité accrue [18, 19]. La mobilisation précoce de ces patients vise à lutter contre l’apparition de cette atrophie musculaire.
La kinésithérapie mise en place est guidée par les capacités fonctionnelles du patient et le résultat de l’évaluation musculaire. Des nombreuses techniques sont décrites dans la littérature et utilisées en pratique clinique [20, 21]. Cependant, ces techniques telles que le Medicin Research Council (MRC) Score ou le test de serrage, nécessitent la coopération du patient et ne peuvent pas être réalisées dans les premières phases de la réanimation, période durant laquelle le phénomène d’atrophie musculaire est plus important [19]. Dans ce contexte, nous retrouvons dans la littérature un intérêt grandissant pour l’utilisation des techniques d’évaluation musculaire non dépendantes de la coopération du patient. Ces techniques permettraient un meilleur dépistage des patients les plus à risque et une meilleure répartition des ressources.
L’évaluation échographique permet l’analyse quantitative et qualitative des muscles avec un bon niveau de fiabilité inter et intra-examinateur, et ce indépendamment du niveau de pratique de l’opérateur et de la gravité de la maladie du patient [22]. Cette évaluation permet de suivre les changements structurels des muscles révélés par un changement de la qualité et la quantité du muscle [23].
Pour cette évaluation, une sonde linéaire sera utile. À notre connaissance, il n’y a pas de consensus dans la littérature quant au muscle à évaluer ou au positionnement du patient ou encore de la sonde échographique. Les muscles le plus décrits sont le droit fémoral, les vastes du quadriceps et le tibial antérieur. Leur évaluation pourra se faire par le biais de mesures comme le calcul de l’épaisseur ou de la surface musculaire, de l’angle de pennation des fibres et de l’échogénicité. La figure 2 illustre différents exemples d’évaluation échographique des muscles périphériques.
L’épaisseur est le paramètre le plus étudié dans la littérature en réanimation. Son calcul correspond à la distance entre les fascias supérieurs et inférieurs d’un muscle (fig. 2 : image A). L’échogénicité du muscle augmente en fonction de la présence de tissus fibreux et de l’atrophie musculaire. Elle peut être calculée de façon quantitative à l’aide de logiciels d’analyse d’image ou de façon qualitative à l’aide de l’échelle de Heckatt. Cette échelle permet de différencier quatre niveaux en fonction de l’échogénicité musculaire et de la réflexion du tissu osseux (fig. 2 : images C et D) [3].
Enfin, pour l’évaluation de l’angle de pennation des fibres, la sonde suivant un axe longitudinal qui permet d’observer l’angle formé entre les fibres musculaires et le fascia sous-jacent. Cet angle est plus important quand les capacités du patient à développer de la force sont plus importantes (le muscle est capable de recruter plus d’unités contractiles) et est donc un bon indicateur de la capacité de force du muscle.
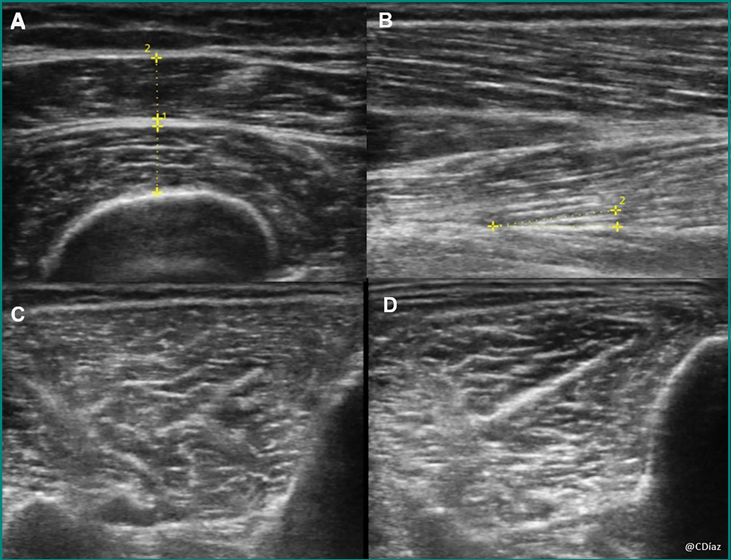
Image A : les lignes jaunes pointillés montrent la mesure de l’épaisseur du droit fémoral (n° 2) et vaste intermédiaire du quadriceps (n° 1)
Image B : exemple d’évaluation de l’angle de pennation formé par l’orientation des fibres musculaires par rapport à la fascia sous-jacent
Image C et D : différents niveaux d’échogénicité musculaire lors de l’évaluation du tibial antérieur
Discussion
En réanimation et soins intensifs, le kinésithérapeute mobilise de nombreuses compétences et participe à une prise en charge complexe qui comprend des défaillances respiratoires, le sevrage de la ventilation mécanique, la prévention des conséquences musculaires et fonctionnelles de la réanimation.
Le projet thérapeutique ainsi que les ressources et compétences à mobiliser découlent du processus d’évaluation pour lequel le kinésithérapeute doit choisir le meilleur outil afin de mettre en place la stratégie la plus efficace.
Nous venons d’étudier de nombreuses situations où l’échographie, grâce à ses performances diagnostiques, à son caractère non invasif et à sa facilité d’utilisation peut être un excellent outil qui viendrait compléter l’évaluation, améliorant le processus diagnostic et par conséquence la prise en charge.
Ainsi, l’échographie peut être utilisée pour l’évaluation de l’état d’aération pulmonaire, du diaphragme, des causes d’échec du sevrage de la ventilation mécanique ou encore des muscles périphériques, notamment durant les premières phases de la réanimation où les capacités de coopération du patient limitent l’évaluation.
Enfin, il est important à noter l’évolution de la littérature sur l’intérêt de l’échographie dans l’évaluation des voies aéro-digestives. Son apport dans l’évaluation des troubles de la déglutition, des lésions des cordes vocales, du stridor post-extubation, du larynx ou encore dans l’évaluation des œdèmes du larynx et ses traitements fait l’objet d’un nombre grandissant de publications ces dernières années [24-26].
Conclusion
L’utilisation de l’échographie dans la prise en charge des patients admis en réanimation ou soins intensifs pourrait améliorer l’évaluation du patient, le suivi de son évolution et la réponse à la rééducation proposée. Une solide compréhension des mécanismes physiopathologiques sont nécessaires afin de profiter du potentiel de cet outil. L’échographie semble être prometteuse pour le kinésithérapeute, que ce soit en pratique clinique ou en tant que critère d’évaluation en recherche, afin d’améliorer le diagnostic et le suivi des dysfonctions rencontrées en réanimation ou en soins intensifs.
Bibliographie
- Gosselink R, Clerckx B, Robbeets C, Vanhullebusch T, Vanpee G, Segers J. Physiotherapy in the Intensive care unit. Netherlands Journal of Critical Care 2011;15(2):10.
- Laursen CB, Clive A, Hallifax R, Pietersen PI, Asciak R, Davidsen JR et al. European Respiratory Society statement on thoracic ultrasound. Eur Respir J 2021;57(3):2001519.
- Formenti P, Umbrello M, Coppola S, Froio S, Chiumello D. Clinical review: Peripheral muscular ultrasound in the ICU. Ann Intensive Care 2019 May;9(1):57.
- Xirouchaki N, Magkanas E, Vaporidi K, Kondili E, Plataki M, Patrianakos A et al. Lung ultrasound in critically ill patients: Comparison with bedside chest radiography. Intensive Care Med 2011;37(9):1488-93.
- Le Neindre A, Mongodi S, Philippart F, Bouhemad B. Thoracic ultrasound: Potential new tool for physiothera- pists in respiratory management. A narrative review. J Crit Care 2016 Feb;31(1):101-9.
- Díaz López C, Ferreiro DC, Le Neindre A. L’échographie pulmonaire peut-elle orienter le choix du traitement en kinésithérapie respiratoire ? Mens Prat Tech Kinésithérapeute [Internet]. 10 déc 2017 [cité 2 mai 2022];593. Disponible sur https://www.ks-mag.com/article/10258-l-echographie-pulmonaire-peut-elle-orienter-le-choix-du-traitement-en-kinesitherapie-respiratoire
- Díaz López C, Le Neindre A. Diagnostic différentiel en kinésithérapie respiratoire ? : intérêt de l’échographie pulmonaire dans l’épanchement pleural. Un rapport de cas. Mens Prat Tech Kinésithérapeute [Internet]. 4 oct 2019 [cité 2 mai 2022];613. Disponible sur https://www.ks-mag.com/article/11508-diagnostic-differentiel-en-kinesitherapie-respiratoire-interet-de-l-echographie-pulmonaire-dans-l-epanchement-pleural-un-rapport-de-cas
- Xirouchaki N, Kondili E, Prinianakis G, Malliotakis P, Georgopoulos D. Impact of lung ultrasound on clinical decision making in critically ill patients. Intensive Care Med 2014;40(1):57-65.
- Le Neindre A, Hansell L, Wormser J, Gomes Lopes A, Díaz López C, Romanet C et al. Thoracic ultrasound influences physiotherapist’s clinical decision-making in respiratory management of critical care patients: A multicentre cohort study. Thorax 2022 Mar 23;thoraxjnl-2021-218217. doi: 10.1136/thoraxjnl-2021-218217.
- Bouhemad B, Brisson H, Le-Guen M, Arbelot C, Lu Q, Rouby JJ. Bedside ultrasound assessment of positive end- expiratory pressure-induced lung recruitment. Am J Respir Crit Care Med 2011 Feb;183(3):341-7.
- Bouhemad B, Mongodi S, Via G, Rouquette I. Ultrasound for « lung monitoring » of ventilated patients. Anesthesiology 2015;122(2):437-47.
- Thille AW, Boissier F, Muller M, Levrat A, Bourdin G, Rosselli S et al. Role of ICU-acquired weakness on extuba- tion outcome among patients at high risk of reintubation. Crit Care 2020 Dec;24(1):86.
- Thille AW, Cortés-Puch I, Esteban A. Weaning from the ventilator and extubation in ICU. Curr Opin Crit Care 2013 Feb;19(1):57-64.
- Dres M, Demoule A. Diaphragm dysfunction during weaning from mechanical ventilation: An underestimated phenomenon with clinical implications. Crit Care 2018 Mar;22:73.
- Le Neindre A, Philippart F, Luperto M, Wormser J, Morel-Sapene J, Aho SL et al. Diagnostic accuracy of diaphragm ultrasound to predict weaning outcome: A systematic review and meta-analysis. Int J Nurs Stud 2021 Jan;117:103890.
- Monnet X, Teboul J. Dysfonction cardiaque gauche lors du sevrage de la ventilation mécanique. Réanimation 2006 Avr;15(2):124-30.
- Ferré A, Guillot M, Lichtenstein D, Mezière G, Richard C, Teboul JL et al. Lung ultrasound allows the diagnosis of weaning-induced pulmonary œdema. Intensive Care Med 2019;45(5):601-8.
- Mayer KP, Thompson Bastin ML, Montgomery-Yates AA, Pastva AM, Dupont-Versteegden EE, Parry SM et al. Acute skeletal muscle wasting and dysfunction predict physical disability at hospital discharge in patients with critical illness. Crit Care Lond Engl 2020 Nov;24(1):637.
- Puthucheary ZA, Rawal J, McPhail M, Connolly B, Ratnayake G, Chan P et al. Acute skeletal muscle wasting in critical illness. JAMA 2013 Oct;310(15):1591-600.
- Vanpee G, Hermans G, Segers J, Gosselink R. Assessment of limb muscle strength in critically ill patients: A systematic review. Crit Care Med 2014;42(3):701-11.
- Cottereau G, Messika J, Megarbane B, Guérin L, da Silva D, Bornstain C et al. Handgrip strength to predict extubation outcome: A prospective multicenter trial. Ann Intensive Care 2021 Oct;11(1):144.
- Mayer KP, Dhar S, Cassity E, Denham A, England J, Morris PE et al. Interrater reliability of muscle ultrasonogra- phy image acquisition by physical therapists in patients who have or who survived critical illness. Phys Ther 2020 Aug;100(9):1701-11.
- Parry SM, El-Ansary D, Cartwright MS, Sarwal A, Berney S, Koopman R et al. Ultrasonography in the intensive care setting can be used to detect changes in the quality and quantity of muscle and is related to muscle strength and function. J Crit Care 2015 Oct;30(5):1151.e9-1151.e14.
- Deng J, Dietrich MS, Ridner SH, Fleischer AC, Wells N, Murphy BA. Preliminary evaluation of reliability and validity of head and neck external lymphedema and fibrosis assessment criteria. Eur J Oncol Nurs Off J Eur Oncol Nurs Soc 2016 Jun;22:63-70.
- El Amrousy D, Elkashlan M, Elshmaa N, Ragab A. Ultrasound-guided laryngeal air column width difference as a new predictor for postextubation stridor in children. Crit Care Med 2018;46(6):e496-501.
- Kandil E, Deniwar A, Noureldine SI, Hammad AY, Mohamed H, Al-Qurayshi Z et al. Assessment of vocal fold function using transcutaneous laryngeal ultrasonography and flexible laryngoscopy. JAMA Otolaryngol Head Neck Surg 2016 Jan;142(1):74-8.
1- Interview de Julien & Camilo, cofondateurs de Rempleo
2- Résultats du sondage national sur rempla kiné
3- Les statistiques Rempleo 2021
4- Kinésithérapie et numérique : nouveautés… et questionnements


0 commentaire